Roztoky a vzorce pro výpočet složení směsí
ROZTOKY
Roztok je homogenní nebo zdánlivě homogenní směs nejméně dvou látek, rozpouštědla a rozpuštěné látky. (Většinou skupenství kapalné, může být však i pevné (slitiny...) i plynné (vzduch...)).Nejčastějším rozpouštědlem jsou kapaliny. Ačkoliv se rozpuštěné látky v rozpouštědle mnohdy štěpí, s rozpouštědlem chemicky nereagují.
Roztok je považován za nasycený, pokud rozpouštědlo za daných okolností není schopno pojmout více rozpustné látky.
Roztok je nenasycený, pokud rozpustíme méně látky, než je za daných podmínek možné.
Přechodně může roztok obsahovat více rozpuštěné látky, než odpovídá rozpustnosti při dané teplotě a takový roztok se jmenuje přesycený.
ROZPUSTNOST - Nejdůležitější vlastnost roztoků - Veličina udávající hmotnost rozpuštěné látky v daném objemu popř. v hmotnosti nasyceného roztoku.
(udává buď jaké nejvyšší množství dané látky lze rozpustit v určitém množství daného rozpouštědla, nebo jaké nejvyšší množství dané látky lze rozpustit za vzniku určitého množství roztoku)
V praxi proto dělíme látky na rozpustné zařadíme ty, kterých je možno ve 100 g rozpouštědla rozpustit více než 1 g
nerozpustné zařadíme ty, kterých se ve 100 g rozpouštědla rozpustí méně než 0,1 g a málo rozpustné 1 - 0,1 g
1>rozpustné
0,1<nerozpustné
Rozpustnost látky závisí na:
a) rozpouštědle (daná látka se například jinak rozpouští v ethanolu a jinak ve vodě)
b) rozpouštěné látce (například NaCl se ve vodě rozpouští mnohem víc než AgCl)
c) přítomnosti dalších látek v roztoku (např. AgCl se více rozpouští v čisté vodě než v roztoku obsahujícím chloridy, kyselina benzoová
se lépe rozpouští v roztoku obsahujícím OH-
ionty než v čisté vodě atd.).
d) teplotě (rozpustnost plynů v kapalinách s rostoucí teplotou obyčejně klesá, rozpustnost pevných látek a kapalin v kapalinách s
rostoucí teplotou většinou – ale ne vždy – roste)
e) tlaku. Týká se jen rozpustnosti plynů. S rostoucím tlakem roste rozpustnost. Přestane-li tlak působit, plyn z kapaliny vyprchá. Příkladem je šumění sodovky po jejím otevření – při odstranění uzávěru v láhvi klesne tlak a v důsledku toho klesne rozpustnost CO2 ve vodě (přesněji řečeno v roztoku tvořícím sodovku) a přebytečný CO2 z roztoku uniká ve formě okem pozorovatelných bublinek.
Vyjadřování složení roztoků
Roztoky činidel používané v analytické chemii jsou uváděny buď s přibližným obsahem složek nebo pro účely stanovení s velmi přesným údajem o složení. Složení dvou- a vícesložkové soustavy se udává zpravidla relativním obsahem jednotlivých složek ve směsi. Poměr složky k množství směsi se označuje jako zlomeknebo koncentrace.
1.1.1. Zlomek
a) Hmotnostní wA, w(A) - udává poměr hmotnosti mA složky A k celkové hmotnosti směsi mS. Je číslem bezrozměrným, menším než jedna.
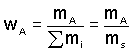 (1)
(1)
Hmotnost směsi mS lze nahradit součinem hustoty ρS a objemu VS soustavy
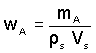 (2)
(2)
V chemii je zvykem vyjadřovat hodnotu hmotnostního zlomku v procentech. Protože procento je setina nepojmenované jedničky (1% = 0,01), lze hmotnostní zlomek zaznamenat vztahem:
![]() (3)
(3)
a hmotnostní procentualitu dané složky v roztoku výrazem
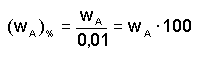 (4)
(4)
|
Objem směsi nelze nahradit součtem objemů složek soustavy - důvodem je možnost kontrakce nebo dilatace celkového objemu. Hodnota objemového zlomku se obvykle vyjadřuje v procentech (objemová procentualita): Vzájemný převod objemového zlomku na hmotnostní a opačně lze uskutečnit pomocí hustot složky A a celé soustavy: |
|
b) Látkový (molární) χA, χ(A) - udává poměr látkového množství složky A k celkovému látkovému množství soustavy: |
1.1.2. Koncentrace
Koncentrace udává množství složky v objemu 1 dm3, resp. v 1 litru a příslušných podílech.
a) Látková cA, c(A) - poměr látkového množství složky A k celkovému objemu soustavy:
Veličina MA je molární hmotnost [g·mol–1] složky A.
Je-li složení roztoku vyjádřeno hmotnostním zlomkem, lze látkovou koncentraci vypočítat pomocí hustoty ze vztahu (10):
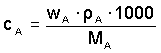 resp.
resp. 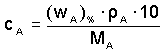 (10)
(10)
Jednotka látkové koncentrace má rozměr [mol·dm–3], resp. [mol·l–1] a symbol M. Např. roztok hydroxidu sodného o koncentraci 0,1 mol·dm–3 (0,1 mol·l–1) je možno zapsat jako 0,1 molární nebo jako 0,1M-NaOH.
b) Hmotnostní δA, δ(A) - poměr hmotnosti mA složky A k celkovému objemu soustavy:
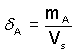 ... rozměr jednotky je [g·l–1], resp. [kg·m–3] (11)
... rozměr jednotky je [g·l–1], resp. [kg·m–3] (11)
- Pozn.:
- Mezinárodní nomenklaturou je termín "koncentrace" doporučen pouze k označení množství složky v definovaném objemu, tzn. mol·dm–3 (mol·l–1), g·dm–3 (g·l–1), příp. dm3·dm–3 (litr·litr–1), mmol·ml–1, mmol·cm–3, nmol·ml–1 atp.

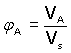 (5)
(5)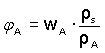 resp.
resp. 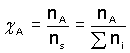
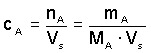 (9)
(9)